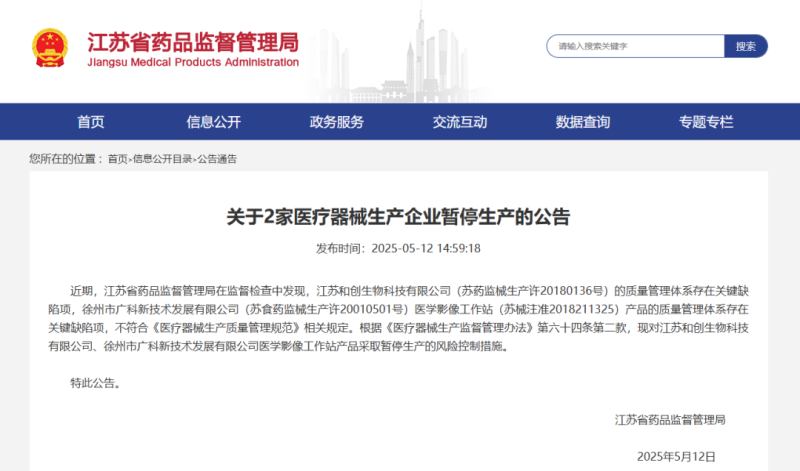
近日,江苏省药监局发布公告称,该局在监督检查中发现,江苏**生物科技有限公司(苏药监械生产许201801**号)的质量管理体系存在关键缺陷项,徐州市**新技术发展有限公司(苏食药监械生产许200105**号)医学影像工作站(苏械注准20182113**)产品的质量管理体系存在关键缺陷项,不符合《医疗器械生产质量管理规范》相关规定。根据《医疗器械生产监督管理办法》第六十四条第二款,现对江苏**生物科技有限公司、徐州市**新技术发展有限公司医学影像工作站产品采取暂停生产的风险控制措施。
延伸阅读 ⌨️《医疗器械生产监督管理办法》第六十四条
生产的医疗器械对人体造成伤害或者有证据证明可能危害人体健康的,药品监督管理部门可以采取暂停生产、进口、经营、使用的紧急控制措施,并发布安全警示信息。
监督检查中发现生产活动严重违反医疗器械生产质量管理规范,不能保证产品安全、有效,可能危害人体健康的,依照前款规定处理。
金飞鹰提醒 医疗器械质量管理体系是产品安全有效的核心保障。作为生产企业,必须严格遵循《医疗器械生产质量管理规范》等法规要求,建立完善的质量管理体系,并在产品全生命周期中持续贯彻实施。
深耕医疗器械行业18年,金飞鹰可为企业提供覆盖产品全生命周期的质量管理体系服务,包括但不限于体系建立、体系优化、现场陪审、培训辅导等,欢迎广大新老客户前来咨询400-888-7587~
往期精彩推荐
# # 2024年,国家药监局共有近400款医械产品不予/终止注册! # 《医疗器械监督管理条例》修订了,具体变化在哪? # 又一省份降费用了!2025年最新医疗器械注册行政收费标准 # 国务院办公厅:全面深化药品医疗器械监管改革,24条新举措明确→ # 广东药监局:正式取消使用数字证书(CA)办理线上业务
近日,江苏省药监局发布公告称,该局在监督检查中发现,江苏**生物科技有限公司(苏药监械生产许201801**号)的质量管理体系存在关键缺陷项,徐州市**新技术发展有限公司(苏食药监械生产许200105**号)医学影像工作站(苏械注准20182113**)产品的质量管理体系存在关键缺陷项,不符合《医疗器械生产质量管理规范》相关规定。根据《医疗器械生产监督管理办法》第六十四条第二款,现对江苏**生物科技有限公司、徐州市**新技术发展有限公司医学影像工作站产品采取暂停生产的风险控制措施。
⌨️《医疗器械生产监督管理办法》第六十四条
生产的医疗器械对人体造成伤害或者有证据证明可能危害人体健康的,药品监督管理部门可以采取暂停生产、进口、经营、使用的紧急控制措施,并发布安全警示信息。
监督检查中发现生产活动严重违反医疗器械生产质量管理规范,不能保证产品安全、有效,可能危害人体健康的,依照前款规定处理。
医疗器械质量管理体系是产品安全有效的核心保障。作为生产企业,必须严格遵循《医疗器械生产质量管理规范》等法规要求,建立完善的质量管理体系,并在产品全生命周期中持续贯彻实施。
深耕医疗器械行业18年,金飞鹰可为企业提供覆盖产品全生命周期的质量管理体系服务,包括但不限于体系建立、体系优化、现场陪审、培训辅导等,欢迎广大新老客户前来咨询400-888-7587~
医疗器械注册咨询认准金飞鹰
深圳:0755-86194173
广州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江苏:135-5494-7827
广西:188-2288-8311
海南:135-3810-3052
重庆:135-0283-7139


