二类医疗器械注册证注销
(二)申请人是在广东省辖区范围依法进行登记的生产企业。
(三)申请资料符合要求。
- 立即咨询
-
全国服务热线:
400-888-7587

400-888-7587
♛ 办理条件 / Conditions
申请医疗器械注册证书注销应符合以下条件:
(一)原医疗器械注册证为广东省药品监督管理局核发,申请的医疗器械注销的注册证在有效期内。
(二)申请人是在广东省辖区范围依法进行登记的生产企业。
(三)申请资料符合要求。
政府官方原文链接:
https://www.gdzwfw.gov.cn/portal/guide/11440000MB2D0344212440172015009
۞ 申请材料清单 / List of application materials
1、医疗器械注册证自行注销申请表 2、生产企业资格证明文件 3、医疗器械注册证书 | 4、该企业负责人身份证复印件(企业负责人办理时);或者企业出具的本企业注册申请事务办理人员的授权书及该办理人身份证复印件(非企业负责人办理时) 5、企业提交的资料真实性的自我保证声明:包括所提交资料的清单以及承担法律责任的承诺 |
✪ 办理依据 / Processing basis
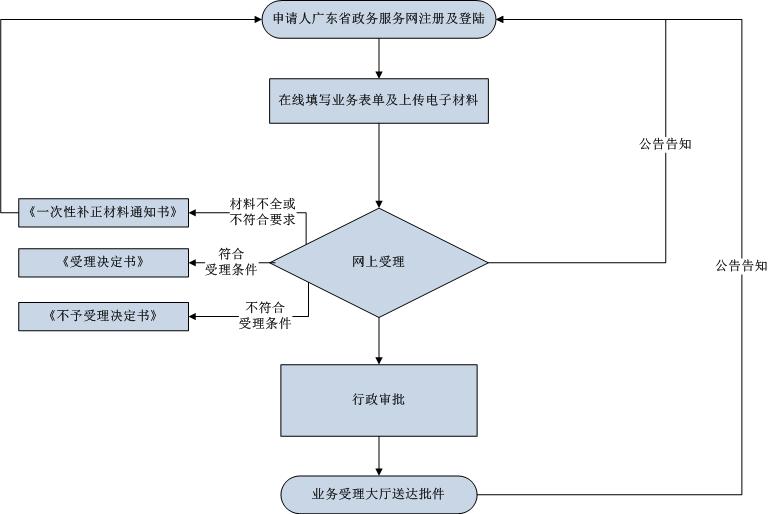
❈ 特殊环节依据 / Special link basis
名称 | 说明 | 时限 |
法定办结时限 | 省局行政审批部门自接到申请资料起,应当在 20 个工作日内核实有关情况后,作出是否注销的决定。 | 20(工作日) |
承诺办结时限 | 省局行政审批部门自接到申请资料起,应当在 10个工作日内核实有关情况后,作出是否注销的决定。 | 1(工作日) |
| 到现场次数 | 0次 |
✪ 办理依据 / Processing basis
1. 法律法规名称:《体外诊断试剂注册管理办法》 依据文号:国家食品药品监督管理局总局令第5号第七十五条 | 2. 法律法规名称:《医疗器械注册管理办法》 依据文号:国家食品药品监督管理局总局令第4号第六十五条 |
〠 金飞鹰相关服务 / Golden Eagle related services
●注册证注销确认 ●产品分类确认或申报 ●注册单元确认 ●创新医疗器械申报 ●产品技术要求确认 ●产品样品送检文件准备 ●产品送检及检验报告跟踪 ●生产厂房规划及平面图设计 ●产品研发过程辅导 ●生产设备及检验设备、设施清单确定 ●无菌或无尘厂房设施验证 | ●灭菌工艺验证 ●包装工艺验证 ●特殊过程验证 ●注册资料申报 ●注册资料递交 ●人员培训 ●体系考核申报资料准备 ●何等考核申报资料递交 ●质量管理体系文件编制 ●产品技术文档建立 ●体系考核现场检查预检查 | ●体系考核后不符合项改善 ●注册资料发补 ●临床试验CRO ●临床试验备案 ●注册人制度质量协议 ●委托方资格申核 ●委托方委托合同 ●企业委托设计 ●产品注册专家答辩资料准备 ●产品注册专家答辩模拟 ●与政府主管机构联络及技术咨询 |
〠 结果样本 / Results the sample

全面解决您的研发、生产、验收、营销全流程问题

practical experience
2000多个二、三类医械项目经验沉淀,为你分配做过相同案例的实战老师。
Professional translation
汇聚7大语种专业翻译精英,多年医械行业翻译经验,能准确翻译专业名词及用语。
Software development
强大的软件研发团队,已为集团研发出成熟的项目管理软件,可提供软件定制服务。
Group supply chain
严选数十个优秀的医械行业服务机构,可为客户推荐更实惠的医械配套服务。
多次创造二三类高风险产品一次性通过的行业纪录
项目状态:已结案
项目辅导老师:李老师
项目状态:已结案
项目辅导老师:车老师
项目状态:已结案
项目辅导老师:王老师
项目状态:已结案
项目辅导老师:黄老师