FDA QSR820验厂辅导及改善483报告
美国国会是法律的制定机构.其制定的《联邦食品药品和化妆品法案(Federal Food, Drug and Cosmetic Act)》是美国关于医疗器械管理的最高法律性文件。
- 立即咨询
-
全国服务热线:
400-888-7587

400-888-7587
♛ 办理介绍 / Introduction
✪ FDA QSR820也叫QSR (Quality System Regulation) ,是21 CFR 820的一种简易叫法。
✪美国国会是法律的制定机构.其制定的《联邦食品药品和化妆品法案(Federal Food, Drug and Cosmetic Act)》是美国关于医疗器械管理的最高法律性文件。
✪美国食品药品监督管理局(FDA)是负责医疗器械管理的政府机构。其根据各相关法律授权而制定的各类法规性的文件编号为21CFRxxxx(xxxx为阿拉伯数字)。 其中21CFR820是FDA根据<联邦食品,药品和化妆品法案>第501、502、 510、 513、 514、 515、 518、 519、 520、 522、 701、 704、 801、 803条款的授权而制定的规范医疗器械企业质量体系要求的法规,即Quality System Regulation,简称QSR或QSR820。
✪QSR 820质量体系规范中描述了现行的生产管理规范的要求(CGMP)。本规范要求规定了所有医用器械成品在设计、制造、包装、标签、贮存、安装和服务中使用的方法,设施和控制。这些要求是为了确保医疗器械成品的安全和有效,并遵从美国食品药品和化妆品法。本规范提出了适用于医疗器械成品制造商的基本要求,如果某制造商只进行本规范规定的一部分操作,而不进行其他操作,则该制造商仅需执行适用于他所进行操作的那些要求。有关1类器械,设计控制仅按在§820.30(a)(2)中列出的要求进行。这个规范不适用于成品组件和零件的制造商,但鼓励这样的制造商使用规范的适当规定作为指导。
✪现行版本的QSR820颁布于1996年10月7日,正式生效于1997年6月1日,亦被称为美国医疗器械行业的现行良好的规范(Current Good Manufacture Practice,简称cGMP)。全文一共15个章节:
A 总则
B 质量体系要求
C 设计控制
D 文件控制
E 采购控制
F 识别与可追溯性
G 生产于过程控制
H 验收活动
I 不合格产品
J 纠正与预防措施
K 标签与包装控制
L 搬运,存储,发运与安装
M 记录
N 服务
O 统计技术
✪总体而言,这是一套在结构上不同于IS013485要求上与IS013485基本相同,规定上更加明确的质量管理体系法规。
㉿ 办理流程 / Processing process
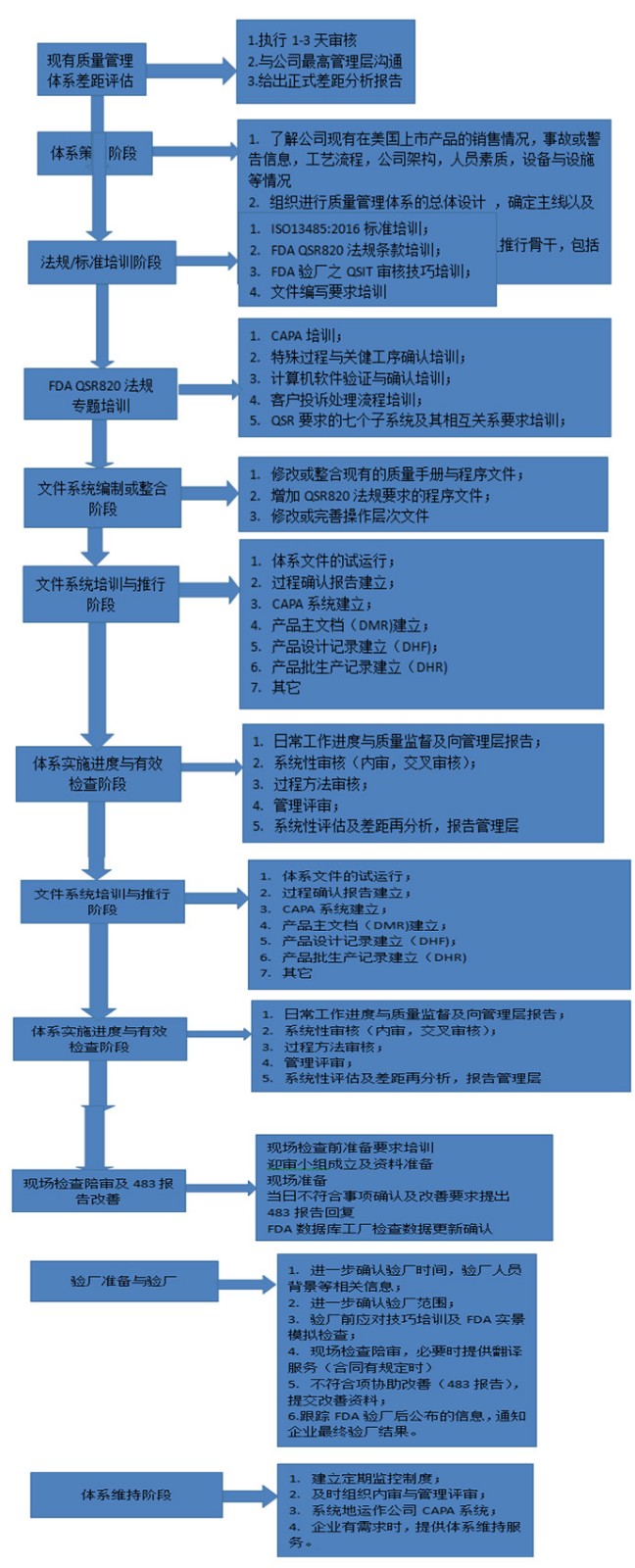
〠 金飞鹰相关服务 / Golden Eagle related services
✪ 通用培训服务
序号 | 培训项目 | 顾问阶段 | 培训人员 |
1 | FDA QSR820条文讲解与宣贯 | 导入标准 | 部门主管、文件编写员 |
2 | FDAQSR820文件编写培训 | 系统建立 | 部门主管、文件编写员 |
3 | 质量体系文件实施前培训 | 系统建立 | 各部门主管 |
4 | QSR820法规系列要求培训 | 实施 | 全体人员 |
5 | FDA验厂前应对技巧培训 | 实施 | 内审员、相关部门 |
6 | 管理评审培训 | 实施 | 中层管理人员 |
7 | 统计技术培训 | ||
8 | FDAQSR820实施前动员培训 | 实施 | 相关人员 |
9 | FDAQSR820认证前宣贯培训 | 取证 | 基层以上管理人员 |
✪ 专题培训服务
序号 | 培训项目 | 主要内容 | 培训人员 |
1 | 美国医疗器械管理概况 | ■医疗器械管理机构 ■FDA管理部门组织结构图 ■法律法规 ■分类管理 ■510K和PMA | 部门主管、文件编写员 |
2 | 主要的质量管理法规、标准及其关系 | ■ISO13485-质量管理体系 ■ISO9001-质量管理体 ■标准与法规的关系 ■ISO13485与QSR820的差异对比 ■如何由ISO13485体系提升到满足QSR820体系 | 部门主管、文件编写员 |
3 | QSR的基本内容及其详细解读 | ■820.20 管理职责 ■820.30 设计控制 ■820.40 文档控制 ■820.50 采购控制 ■820.60 标识和追溯性 ■820.70 生产和过程控制 ■820.80 接收活动 ■820.90 不合格品控制 ■820.100 纠正预防措施 ■820.120~130 标签和包装控制 ■820.140~170 搬运、储存、分发和安装 ■820.180 记录 ■820.200 服务 ■820.250 统计技术 | 各部门主管 |
4 | QSR的七个子系统及其相互关系 | ■设计控制 ■生产和过程的控制 ■原料的控制 ■工具和设备的控制 ■记录文件和更改的控制 ■纠正预防措施 ■管理 | 各部门主管 |
5 | 纠正与预防措施(CAPA) | ■ISO13485、QS820关于纠正预防措施的要求; ■纠正预防措施实施经常遇到的困扰; ■正确理解和掌握纠正、纠正措施、预防措施; ■不合格的来源和报告责任; ■不合格描述; ■原因分析方法和工具; ■解决问题的选方案实施方案 ■效果审计 ■纠正预防措施的分层管理责任制; | 内审员、相关部门 |
6 | 过 程 确 认 Process Validation | ■需确认的过程 ■过程确认的方法和工具 ■重新确认 ■回顾性的过程确认 | 中层管理人员 |
7 | DMR/DHF设计控制培训 | ■ 确定K号产品 ■ 检查510K文件中产品标签的一致性 ■ 检查原设计文件,完善,补充设计文件中评审、验证、确认部份的证据 ■ 检查产品设计变更情况,完善变更前的评审及证据收集 ■ 整理产品DHF文件 | 工程技术人员 |
8 | CAPA系统改善培训 | 生产,品质,采购,销售等管理人员培训 | |
9 | MDR客户投诉及产品召回培训 | 销售,品质人员培训 | |
10 | 电子记录与电子签名培训 | 相关部门管理人员 |
✪ 体系建立过程服务
序号 | 推行阶段 | 金飞鹰公司的主要服务内容 |
| 1 | 体系诊断 | 依标准要求,了解和诊断贵公司现有的体系,作为构建新体系的依据。 |
| 2 | 体系构建 | 依诊断结果,整理贵公司所需要的体系文件清单,并与贵公司各阶层负责人讨论 |
| 3 | 成立推行小组 | 与贵公司筹组认证推行小组及组织有关骨干人员 |
| 4 | 教育训练 | 1.FDA及QSR820简介导入要领; 2.标准条文具体解析; 3.体系文件编写培训。 |
| 5 | 体系建立 | 根据质量体系文件和技术文件编写计划实施个别指导与集体辅导相结合 |
| 6 | 体系落实执行 | 与各部门检查实施状况并做必要的修正 |
| 7 | 内部质量体系审核 | 1.组成审核小组,带领内审员审核体系落实状况; 2.设计管理评审及外审。 |
| 8 | 现场检查 | 1.成立现场检查工作小组 2.联系FDA现场考核官; 3.确定现场检查时间; 4.跟踪现场检查审核全过程 5.确定483报告内容及制定纠正和预防措施 6.向FDA上报整改资料 7.现场检查结果跟踪。 |
全面解决您的研发、生产、验收、营销全流程问题

practical experience
2000多个二、三类医械项目经验沉淀,为你分配做过相同案例的实战老师。
Professional translation
汇聚7大语种专业翻译精英,多年医械行业翻译经验,能准确翻译专业名词及用语。
Software development
强大的软件研发团队,已为集团研发出成熟的项目管理软件,可提供软件定制服务。
Group supply chain
严选数十个优秀的医械行业服务机构,可为客户推荐更实惠的医械配套服务。
多次创造二三类高风险产品一次性通过的行业纪录
项目状态:已结案
项目辅导老师:李老师
项目状态:已结案
项目辅导老师:车老师
项目状态:已结案
项目辅导老师:王老师
项目状态:已结案
项目辅导老师:黄老师