香港医疗器械注册
目前,该制度为自愿性制度,以后将渐渐过渡到最终立法成为强制制度。
- 立即咨询
-
全国服务热线:
400-888-7587

400-888-7587
♛ 办理介绍:
✪香港医疗器械法规,称为医疗仪器行政管理制度,该法规由医疗器械控制办公室(MDCO)制定,医疗器械审批符合管理制度,MDCO有权把任何视为适当的资料纳入”表列”,并有权把表列向公众开放。
目前,该制度为自愿性制度,以后将渐渐过渡到最终立法成为强制制度。
✪ 器械分类
按照GHTF标准,和风险把医疗器械分为四级:级别分为I,II,III和IV级,级别越高,监管要求越严格。
♛ 香港医疗器械注册的技术文件准备:
✪ 对于非本地区制造商:
根据医疗器械分类规则对器械进行分类。采用GHTF公布的分类规则,通常,器械的分类与欧盟(EU)中的分类相匹配。非本地制造商将可以利用其在澳大利亚,加拿大,欧盟,日本或美国的现时有效上市许可证明。
I类器械没有注册过程,也无法注册(即使是自愿注册)。您可以直接上市I类器械。以下所有说明将参考II,III和IV类器械的过程。
第一步:
找到一家合资格的当地公司作为本地负责人(LRP),LRP将负责协调您的申请和提交以及上市后的警戒活动,假如非本地制造商在香港设有分公司,与海外制造商同名,也可作为LRP。
第二步:
提供澳大利亚,加拿大,欧盟,日本或美国的现时有效上市许可证明,如CE证书,FDA 510(k)letter。
第三步
准备填写申请表,提交CE证书或FDA 510(k) letter副本,ISO 13485证书,技术文件,文件以中文或英文提供,或随附中文或英文译文。
第四步
任命一名香港的授权进口商。
第五步
LPR把申请治疗递交给MDCO.
第六步
MDCO审核申请,并可能要求提供其他文件或澄清,LRP要及时对MDCO进行回复。
第7步
批准后,将为医疗器械分配一个香港医疗器械编号,并在官网数据库中列出,批准有效期为5年,LRP必须在到期前至少3个月向MDCO提交延续申请。
✪ 本地制造商:
第一步
可由本地制造商充当本地负责人(LRP)。
第二步
建立ISO 13485质量管理体系,产品送检,准备相关申请表和技术文件。
第三步
选择指定的公告机构,签约,排期。
第四步
公告机构对质量管理体系和技术文件进行审核,如有需要,做出整改,出具审核报告。
第五步
审核批准后,公告机构颁发证书。
㉿ 办理流程 / Processing process
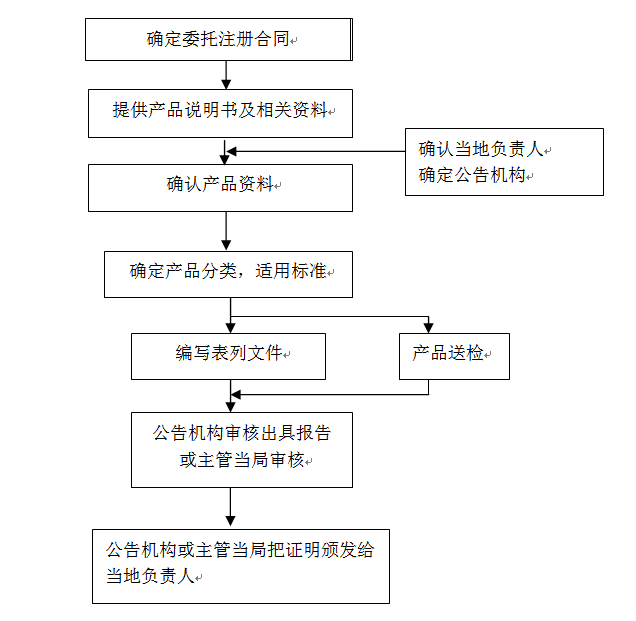
❈ 官方审核时间时间 / Official audit time
| 名称 | 其他 | 其他 |
| 官方审核时间 | 为申请人递交申请及全部所需证明材料 | 12(周) |
〠 金飞鹰相关服务 / Golden Eagle related services
● 通过合作公司提供产品注册全流程注册服务
● 体系认证及验厂服务
● 产品上市后的监管服务
✪ 自愿性表列的优势 / Voluntary list advantages
●在自愿系统下表列的产品,到了强制性制度时,将直接转移到符合法规清单中,而无需提交其他文件。
● 如果您不在自愿名单上,并且已开始实施强制注册,那么会有很多公司试图同时注册排期,这可能会影响您在香港的销售。
●医院和医护人员更有可能使用在自愿名单上的器械。
● 建议医疗器械公司现在申请香港的自愿名单。
● 原产地香港表列后的器械,才能够取得原产地销售核准证明,为作为国内进口医疗器械办理注册的必须文件。
全面解决您的研发、生产、验收、营销全流程问题

practical experience
2000多个二、三类医械项目经验沉淀,为你分配做过相同案例的实战老师。
Professional translation
汇聚7大语种专业翻译精英,多年医械行业翻译经验,能准确翻译专业名词及用语。
Software development
强大的软件研发团队,已为集团研发出成熟的项目管理软件,可提供软件定制服务。
Group supply chain
严选数十个优秀的医械行业服务机构,可为客户推荐更实惠的医械配套服务。
多次创造二三类高风险产品一次性通过的行业纪录
项目状态:已结案
项目辅导老师:李老师
项目状态:已结案
项目辅导老师:车老师
项目状态:已结案
项目辅导老师:王老师
项目状态:已结案
项目辅导老师:黄老师