
金飞鹰直播培训简介
金飞鹰直播培训,是每周一次的固定培训栏目,优选金飞鹰国内外资深注册/项目老师定期为大家讲解医疗器械注册相关知识,解答大家在医疗器械注册过程中的诸多疑问。
此前我们已为大家带来新版医疗器械生物学评价标准、新版医疗器械风险管理标准、医疗器械软件注册、医疗器械质量管理体系提升技巧等共计108次线上培训课程,有兴趣的可点击视频号直播回放进行查看~另外大家也一定很关注接下来的培训主题,相关培训预告我们会陆续添加至视频号,请大家持续关注哦!
划重点!
往期直播培训课程支持回放,关注“金飞鹰药械咨询服务”视频号并点击视频号主页,即可查看“直播回放”哦~
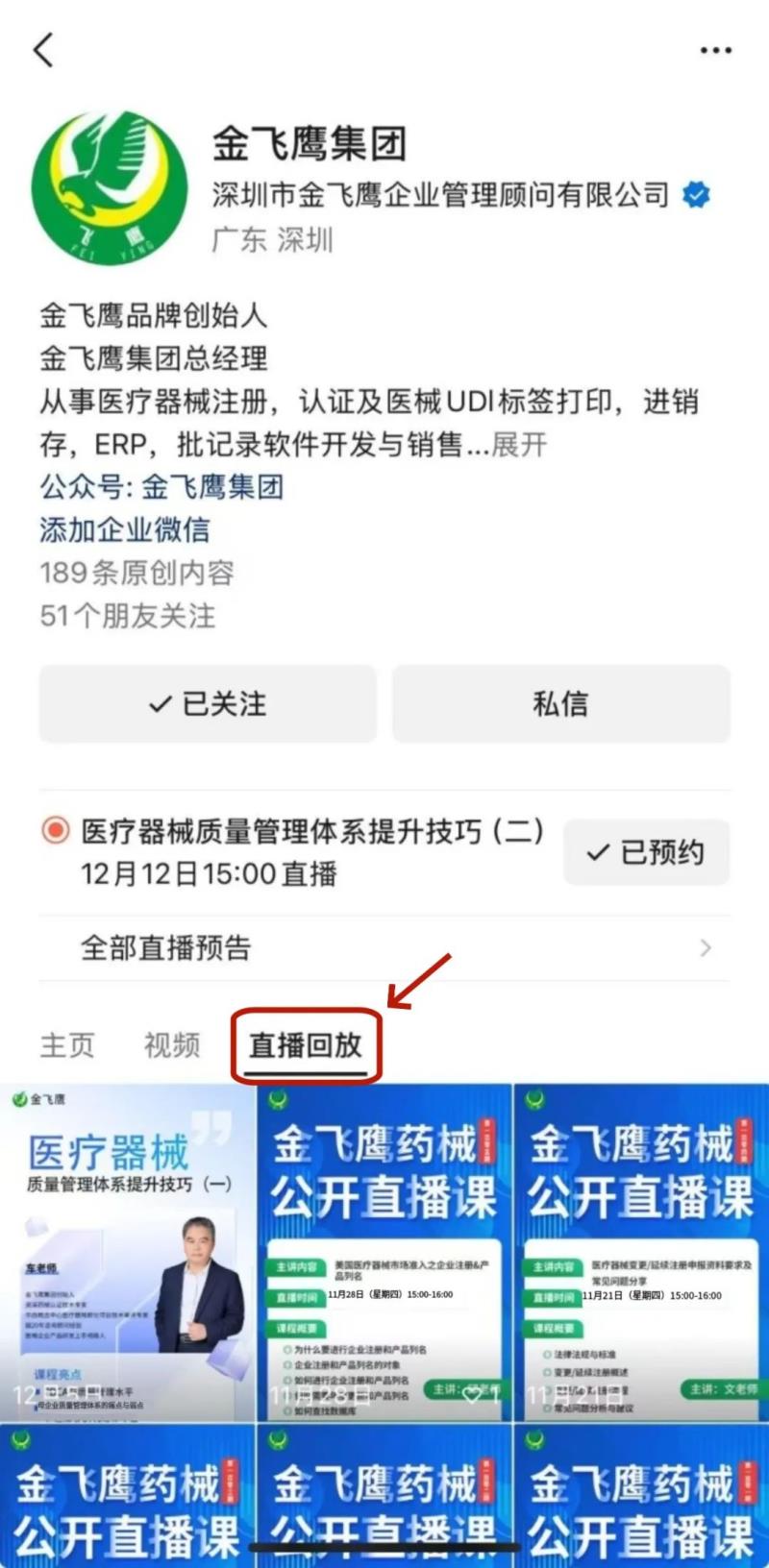
医疗器械注册咨询认准金飞鹰
深圳:0755-86194173
广州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江苏:135-5494-7827
广西:188-2288-8311
海南:135-3810-3052
重庆:135-0283-7139



