7月21日,上海市药监局发布《上海市医疗器械生产企业分级监管实施细则》(以下简称《实施细则》),《实施细则》适用于对上海市医疗器械生产企业开展的日常监督管理活动,所称生产企业包括医疗器械注册人、备案人以及受托生产企业。
我们将《实施细则》正文内容转载如下:
第一章 总 则
第一条 为加强医疗器械生产监督管理,切实落实监管责任,合理配置监管资源,保障医疗器械安全有效,根据《医疗器械监督管理条例》《医疗器械生产监督管理办法》《国家药监局综合司关于加强医疗器械生产经营分级监管工作的指导意见》等规定,制定本实施细则。
第二条 本实施细则适用于对本市医疗器械生产企业开展的日常监督管理活动,所称生产企业包括医疗器械注册人、备案人以及受托生产企业。
第三条 市药品监管局根据企业获准上市生产的医疗器械管理类别、产品是否纳入重点监管品种目录、企业生产质量管理体系运行状况、监管信用记录等,按照“风险分级、科学监管,全面覆盖、动态调整,落实责任、提升效能”原则,将企业分为不同监管级别,明确对应监督检查形式、日常检查频次和覆盖率要求。
第四条 市药品监管局负责拟制《上海市医疗器械生产重点监管品种目录》(以下简称《市级目录》),按年度统筹确定本市医疗器械生产企业的监管级别以及对应的监督检查形式、日常检查频次和覆盖率,统筹日常检查频次调整工作,并将当年度确定的监管级别告知企业。本市各级监管部门按职责分工,根据医疗器械生产企业监管级别开展日常监管,并建立运转顺畅的协同监管机制,形成有效监管闭环。
第二章 监管级别的划分
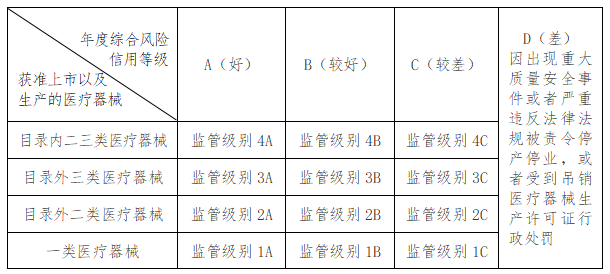
第五条 根据国家《医疗器械生产重点监管品种目录》(以下简称《国家级目录》)和《市级目录》,将本市医疗器械生产企业获准上市以及生产的医疗器械分为四种情形。
(一)一类医疗器械:获准备案或生产的品种涉及第一类医疗器械;
(二)目录外二类医疗器械:获准注册或者生产的品种涉及除《国家级目录》或《市级目录》外其他第二类医疗器械;
(三)目录外三类医疗器械:获准注册或者生产的品种涉及除《国家级目录》或《市级目录》外其他第三类医疗器械;
(四)目录内二三类医疗器械:获准注册或者生产的品种涉及《国家级目录》或《市级目录》所列第二类、第三类医疗器械。
同一医疗器械生产企业获准上市或生产的医疗器械产品涉及多种情形的,按照最高情形进行划分。
第六条 根据本市医疗器械生产企业年度综合风险信用评定情况(评定指标详见附件,市药品监管局可结合监管实际适时调整评定指标),将企业划分为A、B、C、D四个等级。
(一)A级企业表明其生产质量管理体系运行状况及监管信用记录好;
(二)B级企业表明其生产质量管理体系运行状况及监管信用记录较好;
(三)C级企业表明其生产质量管理体系运行状况及监管信用记录较差;
(四)因出现重大质量安全事件或者严重违反法律法规被责令停产停业,或者受到吊销医疗器械生产许可证行政处罚的企业为D级企业,表明其质量管理体系运行状况及监管信用记录差。
第七条 根据本市医疗器械生产企业获准上市以及生产的医疗器械情形、企业年度综合风险信用等级,监管级别划分为以下类别。
第三章 日常检查频次的确定
第八条 监管级别为4A、4B、4C的企业,原则上每年至少组织一次全项目检查。
第九条 监管级别为3A的企业,原则上每两年全项目检查不少于一次;监管级别为3B、3C的企业,原则上每年检查不少于一次且每两年全项目检查不少于一次。
第十条 监管级别为2A、2B、2C的企业,原则上每两年检查不少于一次。
第十一条 监管级别为1A、1B、1C的企业,每年随机抽取本行政区域25%以上的企业进行监督检查。对于首次完成第一类医疗器械生产备案的企业,监管部门应当在企业完成生产备案之日起3个月内开展全项目现场检查。对于变更生产地址或者增加生产范围的第一类医疗器械生产企业,相关监管部门必要时可对其进行现场核查。
第十二条 对于年度综合风险信用等级为D的企业,如属于被责令停产停业,监管部门应当持续跟踪企业整改情况,并在企业提出复产申请后开展全项目检查;通过检查的企业方可恢复生产,并在下一年度至少组织一次全项目检查。
第十三条 市药品监管局根据上级监管要求和监管形势需要,每年确定重点监管情形(包括重点监管企业类型、重点监管品种),有重点监管情形的相关企业原则上不减少日常检查频次。
对于监管级别为4A且无重点监管情形的企业,可酌情减少日常检查频次,每两年全项目检查不少于一次。
对于监管级别为3A且无重点监管情形的企业,可酌情减少日常检查频次,每三年全项目检查不少于一次。
对于监管级别为2A或2B且无重点监管情形的企业,可酌情减少日常检查频次,每三年检查不少于一次。
第十四条 对于因未参加上一年度综合风险信用评定而无法确定监管级别的本市医疗器械生产企业,依照《国家药监局综合司关于加强医疗器械生产经营分级监管工作的指导意见》,明确相应监督检查形式、日常检查频次和覆盖率要求。
第四章 日常检查频次的调整
第十五条 对于当年存在以下任何一种情形的本市医疗器械生产企业,各级监管部门可酌情在下一年度增加日常检查频次:
(一)发生特别重大或重大医疗器械安全突发事件;
(二)责令停产;
(三)责令召回;
(四)涉及医疗器械安全有效性的监督抽检不合格;
(五)未对医疗器械不良事件(死亡或严重)采取有效控制措施;
(六)新增列入《国家级目录》或《市级目录》的医疗器械;
(七)新增国家集中带量采购中选医疗器械;
(八)新增创新医疗器械;
(九)存在较多举报办件且已查实存在违法违规行为;
(十)发生负面舆情;
(十一)属于不具备生产能力的医疗器械注册人,且经监督检查发现涉嫌违法违规行为、存在严重缺陷,无法较好履行主体责任;
(十二)属于仅受托生产医疗器械的企业,且经监督检查发现涉嫌违法违规行为、存在严重缺陷,质量管理体系运行状况较差;
(十三)连续两年及以上综合风险信用等级为C级、D级;
(十四)其他可以增加日常检查频次的情况。
第十六条 对于连续两年综合风险信用等级保持A级的本市医疗器械生产企业,经讨论决定可在下一年度减少日常检查频次。
第十七条 发生传染病、流行病暴发等重大应急事件时,对于涉及应急使用医疗器械的本市生产企业,可临时调整其日常检查频次,并按要求加强监管。
第五章 检查工作要求
第十八条 各级监管部门应当按照年度监管计划,综合运用多种形式的检查强化监督管理,在检查结束并完成检查结果判定后5个工作日内,将检查情况录入检查系统,涉及重大问题的,及时处置并报告。
对本市医疗器械生产企业开展的全项目检查,是指按照医疗器械生产质量管理规范及相应附录,对监管对象开展覆盖全部适用项目的检查,可包括对受托生产企业相应生产活动的检查。
第十九条 结合落实本市药品监管部门规范涉企行政检查有关要求,对于同时生产第一类医疗器械的第二类、第三类医疗器械生产企业,各级监管部门可以合并检查的,原则上应当合并实施检查任务。
第二十条 各级监管部门可自行组织、联合或委托受托生产企业所在地药品监督管理部门,对外省受托企业相应生产活动开展检查,相关检查情况应当及时录入检查系统的“外省受托生产企业检查信息录入”模块。
第二十一条 各级监管部门在开展监督检查过程中,应当督促企业做好产品品种报告、年度自查报告、管理者代表报备、生产条件变化报告、停产后复产情况报告相关工作,并根据检查情况以及品种报告等情况,及时更新企业生产类型、企业状态等信息。
第二十二条 本实施细则未尽事宜,按照国家药品监督管理局相关规定执行。
第二十三条 本实施细则自2025年8月21日起实施,有效期5年,至2030年8月20日止。
以上仅对《实施细则》正文内容进行转载,如需查看正文中提到的附件,请添加文末小编微信或点击“阅读原文”。
信息来源:上海市药监局
以上仅对《实施细则》正文内容进行转载,如需查看正文中提到的附件,请添加文末小编微信或点击“阅读原文”。
信息来源:上海市药监局
排版整理:金飞鹰药械
往期精彩推荐
➋ 未经审查发布医疗器械&处方药广告,广州一公司被罚42万!
➋ 未经审查发布医疗器械&处方药广告,广州一公司被罚42万!
医疗器械注册咨询认准金飞鹰
深圳:0755-86194173
广州:020 - 82177679
湖南:0731-22881823
湖北:181-3873-5940
江苏:135-5494-7827
广西:188-2288-8311
海南:135-3810-3052
重庆:135-0283-7139


