4月7日,国家药监局官网发布《医疗器械临床试验机构监督检查要点及判定原则(征求意见稿) 》(以下简称《检查要点》),并向社会公开征求意见。
意见反馈邮箱:qxzcec@nmpa.gov.cn
意见反馈时间:2023年5月5日前
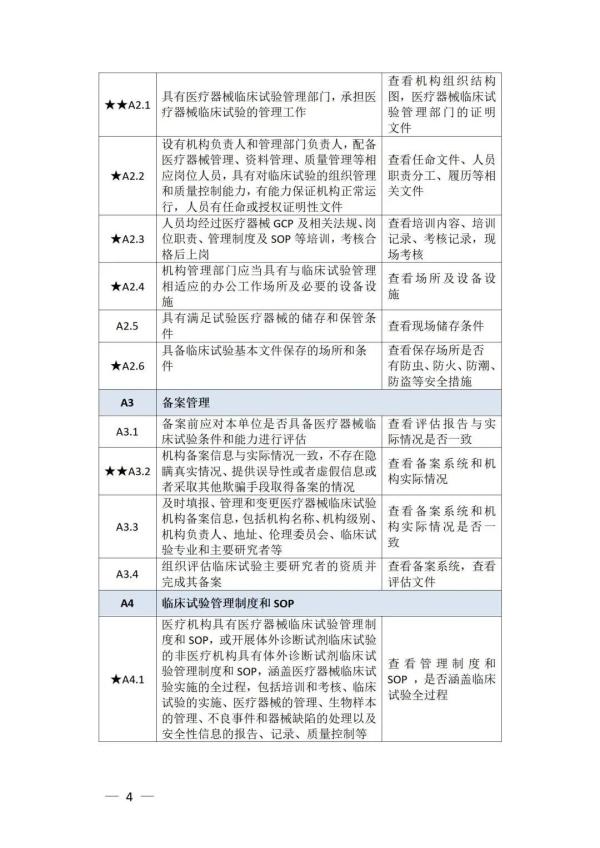
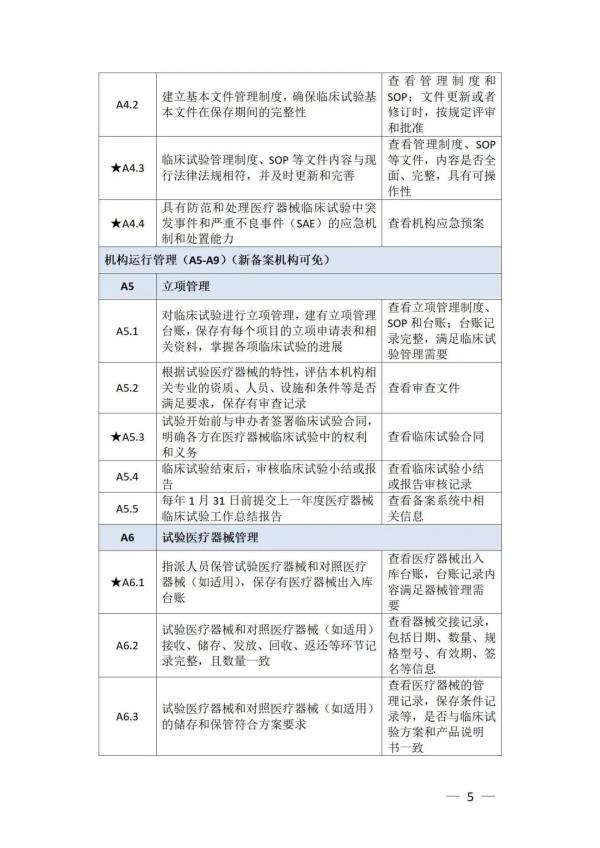
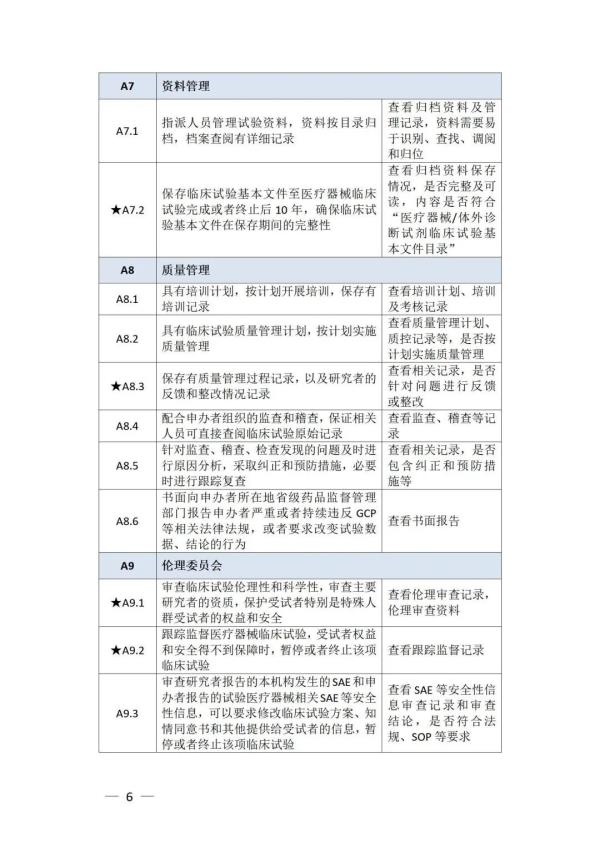
《检查要点》指出,检查内容分为机构和临床试验专业两部分,包括17个检查环节、78个检查项目,包括对条件与备案管理、运行情况等方面的现场检查内容。检查项目中关键项目共计8项(标示为“★★”),主要项目共计34项(标示为“★”),一般项目共计36项。其中8项关键项目具体如下:
① 医疗机构具有医疗机构执业资格及二级甲等以上资质,开展需审批的第三类医疗器械临床试验的,需具有三级甲等资质 ② 开展体外诊断试剂临床试验的非医疗机构具有相应业务主管部门发放的机构资质证明文件 ③ 医疗机构设立伦理委员会,或开展体外诊断试剂临床试验的非医疗机构能够开展伦理审查工作 ④ 配合药品监督管理部门开展检查,保证相关人员可直接查阅临床试验原始记录,无正当理由不得拒绝或不配合检查 ⑤ 具有医疗器械临床试验管理部门,承担医疗器械临床试验的管理工作 ⑥ 机构备案信息与实际情况一致,不存在隐瞒真实情况、提供误导性或者虚假信息或者采取其他欺骗手段取得备案的情况 ⑦ 临床试验专业已在备案平台完成登记备案,不存在隐瞒真实情况、提供误导性或者虚假信息或者采取其他欺骗手段取得备案的情况 ⑧ 主要研究者符合备案条件,具有高级职称
以下为检查要点内容附表 ☟

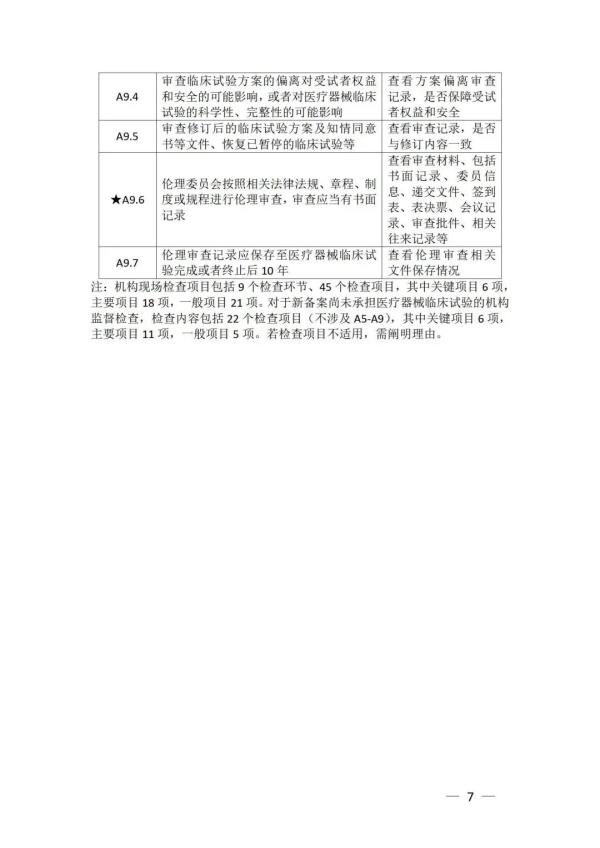
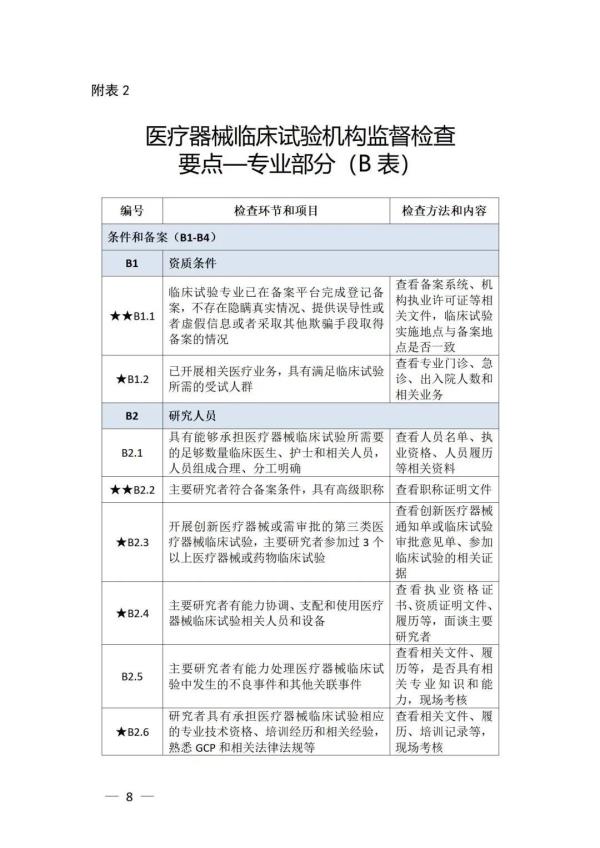
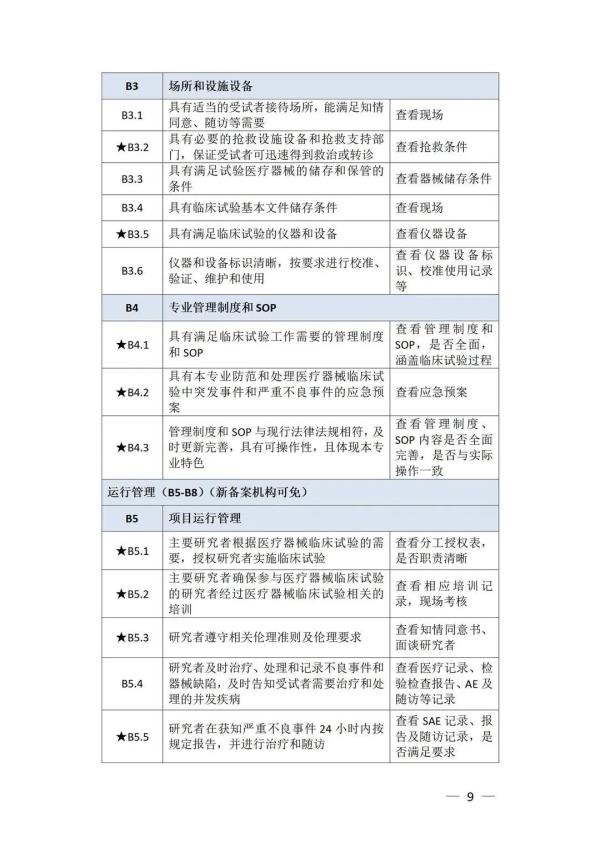
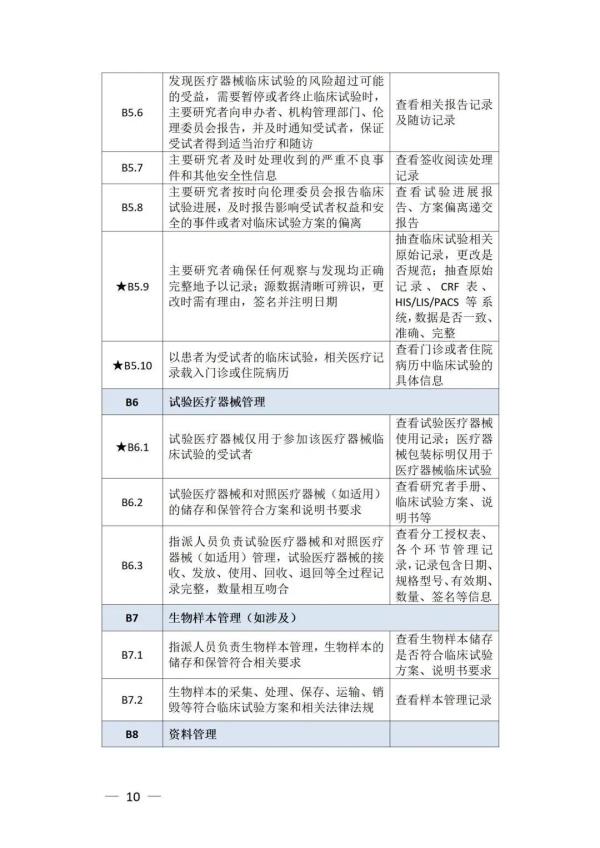

▵ 识别二维码查看附件 信息来源:国家药监局 排版整理:金飞鹰药
医疗器械注册咨询认准金飞鹰 深圳:0755-86194173 广州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295


