《医疗器械质量管理规范》第二十九规定:“在进行设计和开发策划时,应当确定设计和开发的阶段及对各阶段的评审、验证、确认和设计转换等活动,应当识别和确定各个部门设计和开发的活动和接口,明确职责和分工。”
那么企业在进行设计转换活动时,是否有明确的生产数量要求呢,如需生产三台或三批产品?
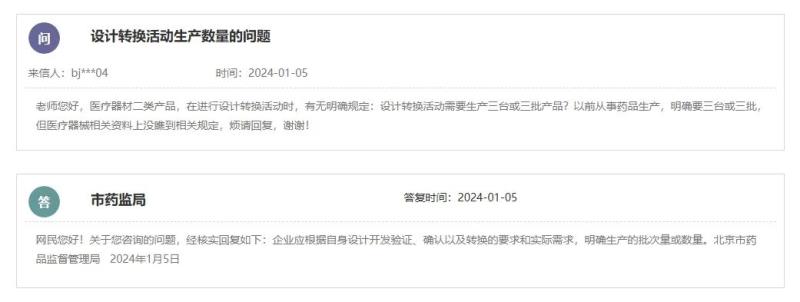
根据北京市药监局的答复,生产数量没有硬性规定,企业应根据自身设计开发验证、确认以及转换的要求和实际需求,明确生产的批次量或数量。
医疗器械注册咨询认准金飞鹰 深圳:0755-86194173 广州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江苏:135-5494-7827 广西:188-2288-8311 海南:135-3810-3052


