生物学评价是医疗器械风险管理的重要组成部分,对于与患者直接或间接接触的器械,应当进行生物学评价。
根据GB/T 16886.1-2022《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》,生物学评价程序应包括对下列方面的优点/缺点和相关性的书面知情考虑:
1)医疗器械构造(如尺寸、几何形状、表面特性)和组成材料清单(定性)以及必要时,该医疗器械中每一材料的比例和量/质量(定量); 2)各种材料的结构和成分的物理特性和化学特性; 3)任何临床使用史或人体接触数据; 4)产品和组件材料、分解产物和代谢物的任何现有的毒理学和其他生物学安全数据; 5)试验程序。
评价可包括相关的已有临床前和临床数据以及实际试验的评审。这样的评价可能得出这样的结论:如果材料具有可证实的安全使用史,并且具有与所设计的医疗器械等同的使用途径和物理形态,则不需要进行试验。当已经能够获得充足的信息进行材料和/或医疗器械的风险评定时,通常不需要再进行试验。
判定如何开展医疗器械生物学评价的具体方法如下图:
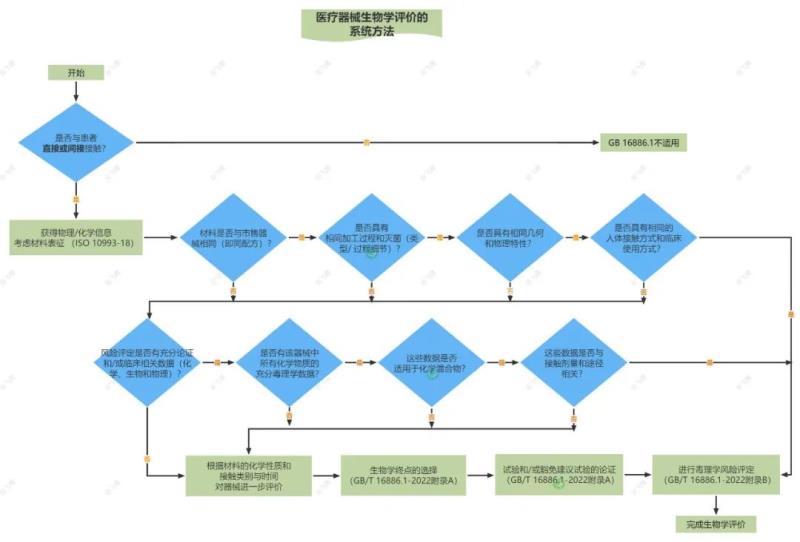
↑ 如需高清大图,可添加文末小编微信领取 ↑
医疗器械注册咨询认准金飞鹰 深圳:0755-86194173 广州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江苏:135-5494-7827 广西:188-2288-8311 海南:135-3810-3052


