检查发现一般不符合项10项。
01
设备方面
1. 某关键原材料进货检验,企业使用自制工装无使用记录,无维护保养记录,未进行确认和再确认。
2. 某关键原材料进货检验,企业使用的光谱仪未校准;关键中间控制过程,企业使用的2台直流稳压电源校准范围未覆盖实际使用范围。
02
文件管理方面
3. 企业不能提供某关键原材料入厂验收准则中个别项目参数制定的评估或验证记录。
4. 企业针对某产品2022年国抽不合格,进行了说明书修订,但不能提供《设计开发控制程序》规定的该设计更改的需求表和评审记录。
03
生产管理方面
5. 企业《特殊过程控制程序》中规定“每年对特殊工序进行再确认”,现场查看某特殊工序的相关确认文件,该工艺过程确认报告完成时间为2017年,不能提供2017年后再确认的相关记录。
6. 抽查某批次的产品批生产记录,未记录某工艺所采用设备编号、工艺涉及的温度和时间等内容。
04
质量控制方面
7. 抽查某批次的产品批生产记录,检验记录中显示进行了某项检测,而企业不能提供开展该测试项目要求的相关文件。
05
销售和售后服务方面
8. 抽查《顾客服务控制程序》文件明确对上市后的产品“售后人员应按定期维护计划表,开展定期维护服务”,而企业不能提供某产品自2019年上市以来的维护计划表以及相关记录。
06
不合格品控制方面
9. 抽查某型号产品的“产品维修记录表”显示有4台设备实施了返工维修,但企业不能提供《返工控制程序》规定的针对该4台返工产品的重新验证记录。
07
不良事件监测、分析和改进方面
10. 抽查某产品的客户投诉及相关处理记录,企业采取返修方式处理,但企业未保留返修的相关记录。
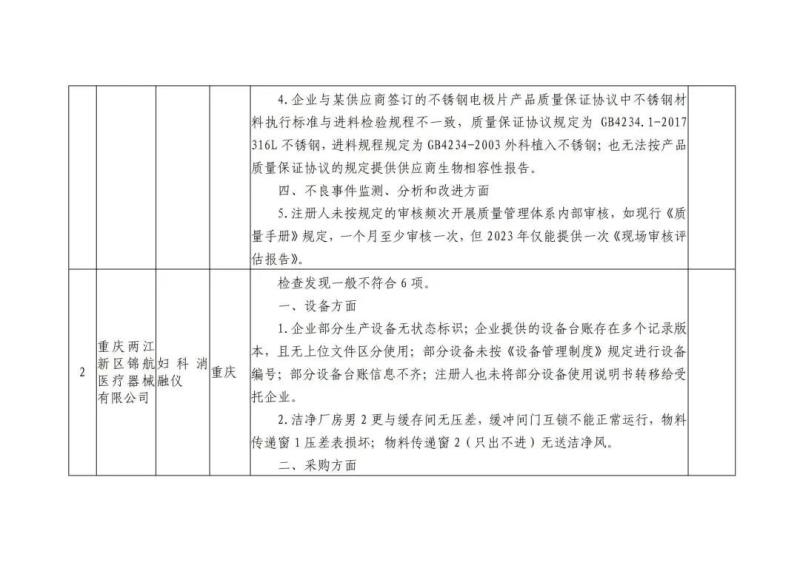
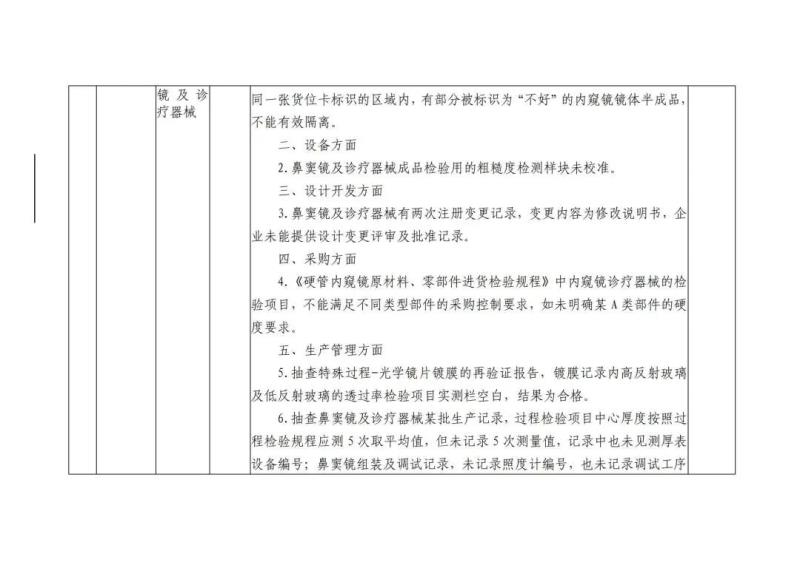
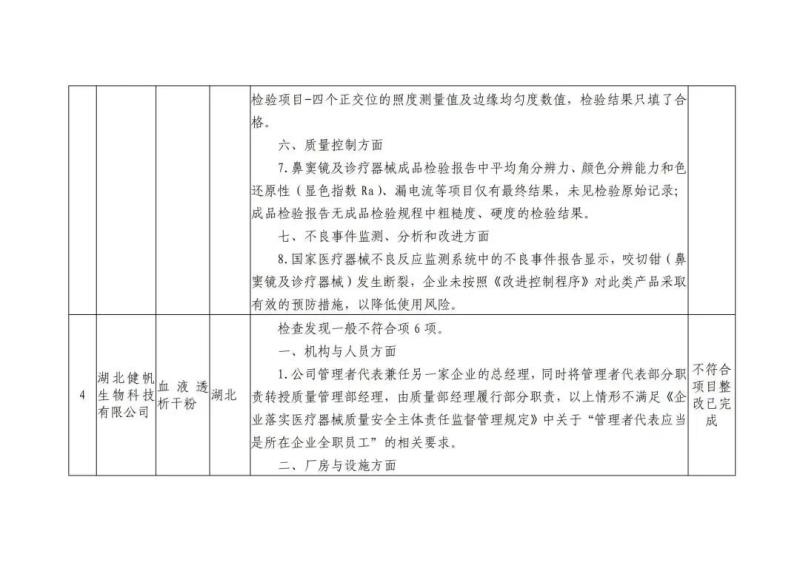
本次“飞检”的10家企业检查发现问题具体如下:











信息来源:国家药监局食品药品审核查验中心
排版整理:金飞鹰药械
医疗器械注册咨询认准金飞鹰 深圳:0755-86194173 广州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295


