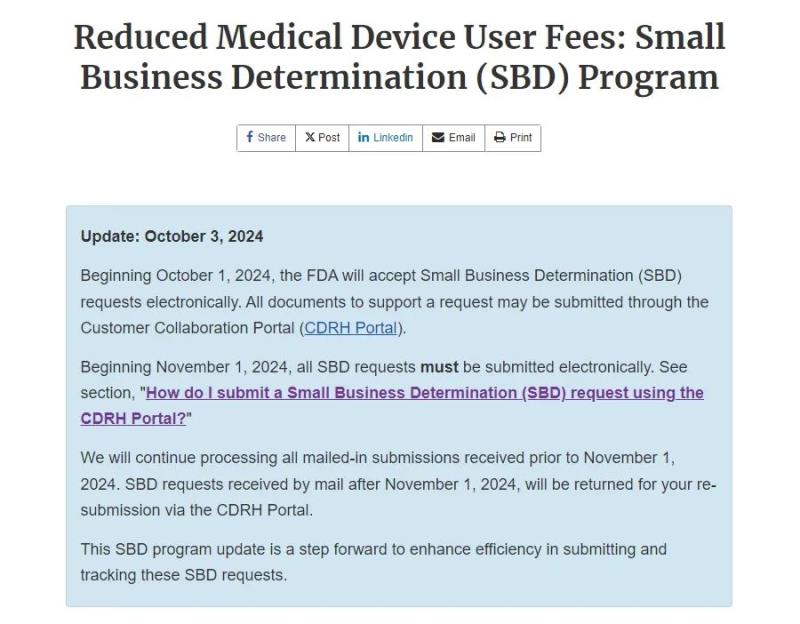
近日,FDA发布了最新公告,自2024年11月1日起,所有小企业资质申请(Small Business Determination,SBD)必须通过FDA的CDRH客户协作门户(CDRH Portal)进行电子提交。此举旨在提高申请效率,缩短审批周期,并加强整个申请过程的透明度。
公告提到,从2024年10月1日开始,FDA将接受电子形式的小企业认定(SBD)请求。支持请求的所有文件都可以通过Customer Collaboration Portal(CDRH Portal) 提交。
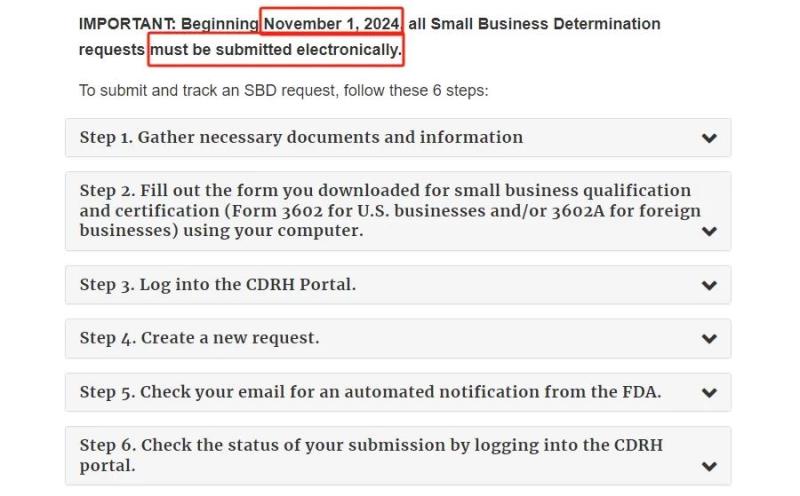
自2024年11月1日起,FDA将停止接受纸质邮寄形式的SBD申请,所有纸质提交的申请将被退回,并要求重新通过电子化渠道进行提交。这意味着申请人必须通过FDA的CDRH门户网站上传所有申请资料,包括必要的税务文件和认证表格,提交和跟踪SBD申请的具体步骤如下:
♦ 收集必要的文件和信息。 ♦ 填写下载的小型企业资格和认证表格(美国企业填写FDA 3602表格,国外企业填写FDA 3602A表格)。 ♦ 登录CDRH门户。 ♦ 创建新请求。 ♦ 检查电子邮件中是否有来自FDA的自动通知。 ♦ 登录CDRH门户检查提交状态。
中国制造商如果符合小企业的资质申请标准(在最近一个纳税年度的总收入和销售额低于1亿美元),可享受多种FDA申请费用的减免优惠,包括510(k)申请、De Novo申请、上市前批准(PMA)申请等,但前提是需由国家税务机关完成相应的认证程序。另外值得注意的是,小企业资质仅限本财年使用,新的财年则需要重新申请。
所有通过CDRH Portal提交的SBD申请可以在门户网站上实时查看进度。FDA将在收到申请后的60个自然日内完成审核,并通过电子邮件向申请人发送审核结果。这将有助于中国企业更好地把握申请的时间节点,为后续产品注册流程做好准备。
金飞鹰在美国医疗器械注册方面有着丰富案例,包括但不限于FDA 510(k)申请、FDA企业注册、一类产品列名、QSR 820体系建立维护、FDA验厂咨询、美国UDI申请、邓白氏码申请、美国代理人服务等,假如您有美国注册相关需求,记得联系我们,我们将全程为您提供高效周到的服务~
医疗器械注册咨询认准金飞鹰 深圳:0755-86194173 广州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江苏:135-5494-7827 广西:188-2288-8311 海南:135-3810-3052


