
近日,FDA发布了FDA发布了针对脉搏血氧仪的最新指南草案。该草案定稿后,将取代2013年版脉搏血氧仪指南。
的来说,本指导文件草案提供了 FDA 关于非临床和临床性能测试的建议,以支持医疗用脉搏血氧仪(包括具有脉搏血氧仪功能的设备)的上市前提交。提出这些建议的部分原因是担心脉搏血氧仪的准确性会受到人的皮肤色素沉着等因素的影响,同时为这些器械的性能评估提供信息,以支持上市前提交(无论提交类型如何),确保一致性,以促进对这些提交的高效审查。
除以上事项外,该指南草案还提供了标签建议,旨在促进脉搏血氧仪的安全和有效使用,并帮助用户了解与使用该设备相关的益处和风险。
接下来,我们就新版指南草案中部分新增内容及大家可能关注的内容进行简单列举:
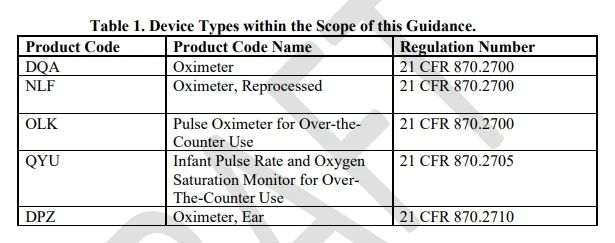
1、设备描述:设备适用范围增加了产品代码为QYU,OLK的血氧仪,其中QYU为非处方婴儿脉率和血氧饱和度监测仪,OLK为非处方使用的脉搏血氧仪。适用的血氧仪设备产品代码见下表。
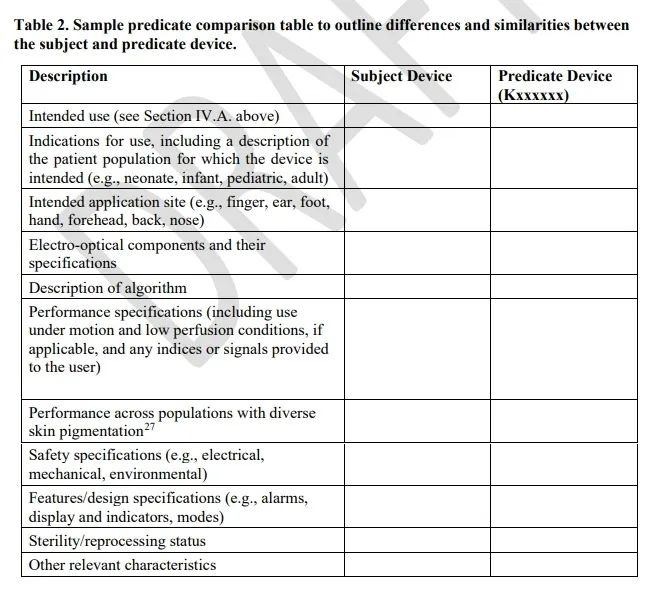
2、规定了等同器械比对的要求
3、标签信息:FDA建议,将标签的要求按如下产品类型进行区分:
所有脉搏血氧仪
处方脉搏血氧仪
OTC(非处方)脉搏血氧仪
之前已通过510k审核的脉搏血氧仪
4、软件:脉搏血氧仪中的设备软件功能可以确保测量准确、可靠和可重复,充分的软件测试可保证设备按预期运行,建议参考FDA软件变更指南、多功能器械指南;增加了网络安全文档的要求。
5、增加人因工程:FDA建议进行可用性评估,以识别潜在的使用错误,并帮助减轻错误来源。要求使用独特的技术或非标准位置的血氧仪在设计初期就进行可用性评估,例如,脉搏血氧仪用于指尖,但以一种新颖的方式固定(例如,不是夹式)或使用不同的技术机制(例如,反射技术而不是透射技术)时。
6、增加无线技术评估:如果产品包含无线射频功能,建议按照以下标准进行测试:AAMI TIR69、IEEE ANSI USE MCSC C63.27。
7、增加磁共振(MR)兼容性要求:对于在磁共振环境中使用的脉搏血氧仪,制造商需确保设备的安全性和兼容性,避免对患者造成伤害。
8、增加了需要重新提交510(k)的重大变更示例(包括但不限于):
对电光传感器进行重大修改(例如,在光路中或附近使用新组件或新绷带材料,对设备进行小型化的广泛重新设计);
SpO2算法的重大修改;
SpO2软件功能的输入参数发生重大变化;
修改患者群体,例如修改为适用于12岁以下的儿科人群。
医疗器械注册咨询认准金飞鹰 深圳:0755-86194173 广州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江苏:135-5494-7827 广西:188-2288-8311 海南:135-3810-3052 重庆:135-0283-7139


