
美国当地时间1月13日,FDA发布了上市前批准申请(PMA)和人道主义器械豁免(HDE)模块审查的最终文件Premarket Approval Application and Humanitarian Device Exemption Modular Review。
FDA的模块化审查指南为医疗器械的审批提供了一种新的、更灵活的方法,特别是在产品的临床研究早期阶段。通过允许分阶段提交和审查非临床数据和制造信息,申请者可以更有效地利用时间和资源,同时FDA也能够更早地介入审查过程,提高审批效率。这一指南的发布,对于医疗器械行业来说是一个重要的进步,有助于加速创新产品的上市进程。不过值得注意的是,模块化审查主要适用于处于临床试验早期阶段的医疗器械。对于接近提交完整PMA或HDE申请,或设备设计尚不稳定的产品,模块化审查可能不太适用。
指南文件附录1中提到的模块化审核流程图如下:
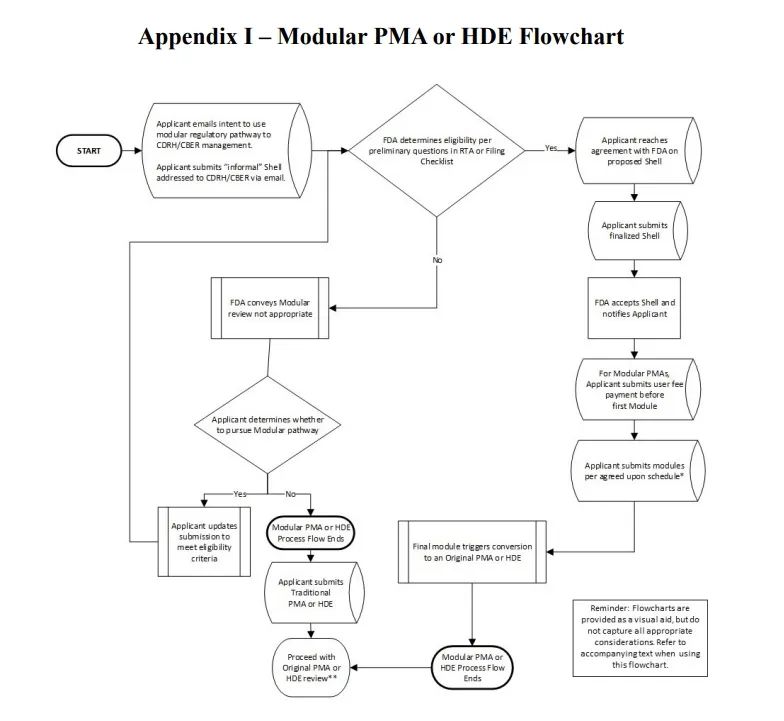
总的来说,该文件详细介绍了模块化审查程序的具体步骤、适用范围、定义、用户费用考虑以及提交模块化PMA或HDE的行业指导,附录后还包含了常见问题解答。
医疗器械注册咨询认准金飞鹰 深圳:0755-86194173 广州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江苏:135-5494-7827 广西:188-2288-8311 海南:135-3810-3052 重庆:135-0283-7139


