随着智能化技术的蓬勃发展,医疗器械领域的通用语言——医疗器械唯一标识(UDI)已在医疗器械全生命周期监管中扮演了举足轻重的角色。全球实施统一UDI路径将有助于医疗器械产品在供应链中的精准识别、产品追溯、召回等。无论企业布局的是国内还是国际市场,UDI的实施都已成为不可忽视的重要环节。
本期文章我们以简单明了的表格形式对中国、美国和欧盟在UDI实施方面(如发码机构、数据库等)进行对比,以供大家参考。

UDI免费沙龙培训 即刻扫码 解锁合规
总的来说,美国是全球范围内最早实施UDI的国家,2007年,FDA补充法案修订联邦法案519条款,加入f部分,明确FDA实施UDI的法律基础。2014年9月,要求Ⅲ类/植入式器械实施UDI,而欧盟和我国在UDI实施方面相对起步较晚,2017年5月,欧盟发布了医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR),设立UDI专章,规定欧洲医疗器械数据库(EUDAMED)相关建设内容。我国则在2019年7月确定了UDI试点品种,2021年1第一批产品正式实施UDI。以下为具体实施时间线:
01
实施时间线
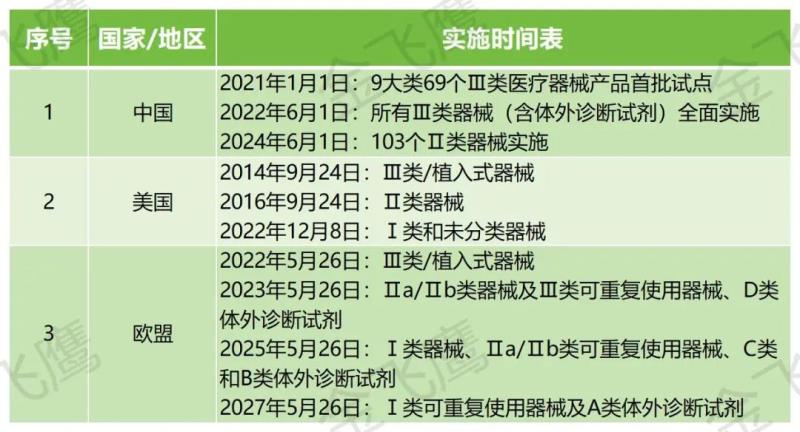
02
发码机构
三者有一个共同发码机构:GS1,因此假如企业销售市场不仅仅局限于国内,就可以选择GS1采用“多码并行”的方式进行赋码,一方面能够减少编码转化的成本,另一方面能够降低转码可能带来的识别错误。

03
数据库
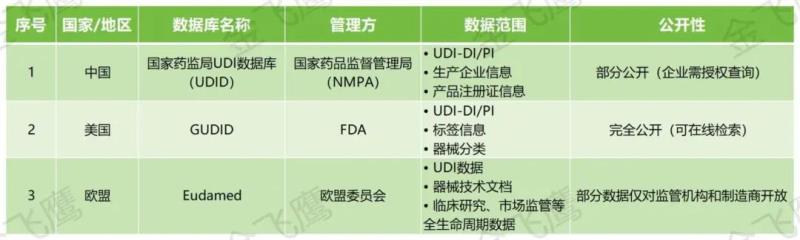
以上就是我们本期分享的中国、美国及欧盟UDI实施的相关内容,假如您有UDI实施需求,欢迎联系我们咨询!
另外,近期我们拟联合苏州优迪艾数字医疗科技有限公司,在金飞鹰深圳总部举办一场【免费】UDI培训沙龙,不仅为您详细解读UDI法规及实施细则,还将通过现场实操演示,带您体验从UDI赋码到条码打印的全过程。欢迎大家识别下方二维码踊跃报名~

随着智能化技术的蓬勃发展,医疗器械领域的通用语言——医疗器械唯一标识(UDI)已在医疗器械全生命周期监管中扮演了举足轻重的角色。全球实施统一UDI路径将有助于医疗器械产品在供应链中的精准识别、产品追溯、召回等。无论企业布局的是国内还是国际市场,UDI的实施都已成为不可忽视的重要环节。
本期文章我们以简单明了的表格形式对中国、美国和欧盟在UDI实施方面(如发码机构、数据库等)进行对比,以供大家参考。

总的来说,美国是全球范围内最早实施UDI的国家,2007年,FDA补充法案修订联邦法案519条款,加入f部分,明确FDA实施UDI的法律基础。2014年9月,要求Ⅲ类/植入式器械实施UDI,而欧盟和我国在UDI实施方面相对起步较晚,2017年5月,欧盟发布了医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR),设立UDI专章,规定欧洲医疗器械数据库(EUDAMED)相关建设内容。我国则在2019年7月确定了UDI试点品种,2021年1第一批产品正式实施UDI。以下为具体实施时间线:

三者有一个共同发码机构:GS1,因此假如企业销售市场不仅仅局限于国内,就可以选择GS1采用“多码并行”的方式进行赋码,一方面能够减少编码转化的成本,另一方面能够降低转码可能带来的识别错误。


以上就是我们本期分享的中国、美国及欧盟UDI实施的相关内容,假如您有UDI实施需求,欢迎联系我们咨询!
另外,近期我们拟联合苏州优迪艾数字医疗科技有限公司,在金飞鹰深圳总部举办一场【免费】UDI培训沙龙,不仅为您详细解读UDI法规及实施细则,还将通过现场实操演示,带您体验从UDI赋码到条码打印的全过程。欢迎大家识别下方二维码踊跃报名~

医疗器械注册咨询认准金飞鹰
深圳:0755-86194173
广州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江苏:135-5494-7827
广西:188-2288-8311
海南:135-3810-3052
重庆:135-0283-7139



暂无留言